Die Grundnährstoffe
A) Eiweißstoffe (Proteine) und Enzyme
Die Bezeichnung Eiweiß leitet sich vom Eiklar (Eiweiß) des Hühnereis ab. Eiweißstoffe sind lebenswichtige Bestandteile der Zellen aller Lebewesen. Sie sind biologische Gerüst- oder Baustoffe und kommen beispielsweise in Muskeln, Haut und Nerven vor. Auch Enzyme (Biokatalysatoren) und manche Hormone, z.B. Insulin, gehören zu den Eiweißstoffen.
Erhitzt man eine Portion von trockenem Eiweiß, so verkohlt es. Außerdem lassen sich Wasserdampf und Ammoniak als Zersetzungsprodukt nachweisen. Es sind also die Elemente Kohlenstoff, Wasserstoff, Sauerstoff und Stickstoff am Aufbau von Eiweißen beteiligt.
Viele Eiweißstoffe sind wasserlöslich. Erhitzt man eine Eiweißlösung, so flockt das Eiweiß aus, es gerinnt (denaturiert, vgl. hartes Ei). Auch Ethanol, Salzlösungen oder Säuren können ein Ausflocken bewirken. Durch Schwermetalle wie Cadmium, Quecksilber, Kupfer oder Blei kann die Struktur der Eiweiße ebenfalls zerstört werden (→ Vergiftung).
Die meisten Eiweiße sind große Moleküle (Makromoleküle) und lassen sich in stark sauren bzw. stark alkalischen Lösungen chemisch in ihre Bausteine (Monomere) zerlegen, die Aminosäuren (Aminocarbonsäuren). Der Name Aminocarbonsäure drückt aus, dass neben der Carboxylgruppe -COOH eine weitere funktionelle Gruppe, die Aminogruppe -NH2, am Bau der Moleküle beteiligt ist.
Nachweis
Im Labor können Eiweißstoffe an bestimmten Farbreaktionen sicher erkannt werden. So wird eine alkalische Eiweißlösung nach Zusatz von Kupfersulfat violett (Biuretreaktion). Mit konzentrierter Salpetersäure entsteht eine Gelbfärbung (Xanthoproteinreaktion). Dieser Nachweis kann auch mit festem Eiweiß durchgeführt werden.
Für diese Nachweisreaktionen sind die entsprechenden Chemikalien notwendig, die in der Grundschule nicht zur Verfügung stehen. Durch die Denaturierung mit Hitze oder Säure können Proteine durch die Grundschulkinder auf einfache Weise nachgewiesen und sicher von Kohlenhydraten und Fetten unterschieden werden.Für diese Nachweisreaktionen sind die entsprechenden Chemikalien notwendig, die in der Grundschule nicht zur Verfügung stehen. Durch die Denaturierung mit Hitze oder Säure können Proteine durch die Grundschulkinder auf einfache Weise nachgewiesen und sicher von Kohlenhydraten und Fetten unterschieden werden.
Bau der Aminosäuren
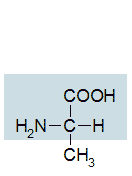
Es gibt etwa 20 verschiedene Aminosäuren (siehe Abb. 1) von biologischer Bedeutung. Sie werden α-Aminosäuren genannt und unterscheiden sich voneinander durch unterschiedliche Molekülreste. Glycin ist die einfachste Aminosäure, an der vierten Bindung des C-Atoms sitzt ein Wasserstoffatom.
 |
 |
 |
 |
| Glycin | Alanin | Glutaminsäure | Phenylalanin |
Abb.1: Einige ausgewählte Aminosäuren, das Grundgerüst, das allen Aminosäuren gemeinsam ist, ist blau unterlegt.
Die Makromoleküle der Eiweiße bestehen aus zahlreichen miteinander verknüpften Aminosäuren, die Verknüpfungsstelle wird Peptidbindung (-CO-NH-) genannt.
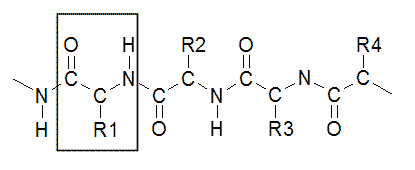 Aus zwei Aminosäuremolekülen entsteht so ein Dipeptid. Durch Verknüpfung mehrerer Aminosäuremoleküle entstehen Oligo- und Polypeptide (Abb. 2, von griech. oligos, wenig; polys, viel).
Aus zwei Aminosäuremolekülen entsteht so ein Dipeptid. Durch Verknüpfung mehrerer Aminosäuremoleküle entstehen Oligo- und Polypeptide (Abb. 2, von griech. oligos, wenig; polys, viel).
Abb. 2: Eiweißmolekül aus mehreren miteinander verknüpften Aminosäuren
Polypeptide, die aus mehr als 100 Aminosäuren aufgebaut sind und eine biologische Funktion besitzen, werden Proteine genannt. Die Reihenfolge, in der die einzelnen Aminosäuren miteinander verknüpft sind (Aminosäuresequenz), bestimmt den Bau und die räumliche Struktur des Proteins (Abb. 3). Um die vielen Möglichkeiten der Kettenbildung auf zu zeigen wurden bei der nebenstehende Kette vier verschiedenen Aminosäuren verwendet.
 Die einzelnen Aminosäuren können miteinander in Wechselwirkung treten (gestrichelte Linien) und so die Form des Proteins festlegen. Tauscht man nur eine dieser Aminosäuren gegen einen andere aus kann dies Veränderungen in der räumlichen Struktur des Proteins haben und seine Wirkung beeinträchtigen.
Die einzelnen Aminosäuren können miteinander in Wechselwirkung treten (gestrichelte Linien) und so die Form des Proteins festlegen. Tauscht man nur eine dieser Aminosäuren gegen einen andere aus kann dies Veränderungen in der räumlichen Struktur des Proteins haben und seine Wirkung beeinträchtigen.
Abb. 3: Ausschnitt aus der Aminosäureabfolge einer längeren Polypeptidkette

Am Beispiel des Hämoglobins (einem Protein, das in den roten Blutkörperchen vorkommt und dessen Aufgabe der Sauerstofftransport im menschlichen Blut ist) lässt sich zeigen, wie groß die Bedeutung ist, die dem räumlichen Bau der Aminosäuresequenz zukommen kann. Hämoglobin besteht aus vier miteinander verknüpften, paarweise gleichen Polypeptidketten mit insgesamt 574 Aminosäuren. Bei der Sichelzellenanämie führt eine kleine Veränderung der Sequenz, der Einbau nur einer "falschen" Aminosäure in die Kette, zu einer Veränderung im räumlichen Bau und damit zu einer erheblichen Störung der Versorgung mit Sauerstoff. Die normalerweise scheibenförmigen roten Blutkörperchen werden vor allem im sauerstoffarmen, venösen Blut sichelförmig. Diese Sichelzellen sind zum Sauerstofftransport nicht mehr befähigt und werden abgebaut.
Abb. 4: Sichelzellenanämie (http://de.wikipedia.org/w/index.php?title=Datei:Sicklecells.jpg&filetimestamp=20060312185613, gemeinfrei)

