4. Wasser und Seife - Wirkung von Tensiden
4.1 Geschichtliche Entwicklung von Seifen
Im Altertum wird Seife, die aus Fett und Asche bestand, besonders in ärztlichen Schriften zur Salbenherstellung erwähnt. Das lässt darauf schließen, dass sie in dieser Zeit wenig zum Waschen und Reinigen benutzt wurde. Überlieferungen zeigen jedoch, dass schon in der Antike das Waschen von Textilien gebräuchlich war, um Gewebe aus Wolle oder Leinen von anhaftendem Schmutz zu befreien. Es war auch bereits bekannt, dass man die mäßige Reinigungskraft von Wasser gegenüber fettigen Verschmutzungen durch geeignete Zusätze erheblich verbessern konnte. So findet man die älteste Beschreibung eines Verfahrens zur Seifenherstellung auf etwa 5000 Jahre alten Tontafeln der Sumerer.
Seifen, zuerst die Kaliseife (Schmierseife) und später die Natronseife (Kernseife), spielten seit dem Mittelalter eine zunehmende Rolle. Ihre Ausgangsstoffe Asche und Talg waren aber knappe und begehrte Rohstoffe. Die Herstellung der Seife war langwierig und anstrengend. So war Seife wegen des hohen Preises kein Allgemeingut, sondern galt als Luxusartikel zur Körperpflege.
Erst durch die industrielle Produktion seit dem 19. Jahrhundert steht Seife allen Bevölkerungsschichten zur Verfügung. Es trat eine so weitgehende Verbilligung ein, dass Seife zur täglichen Hygiene und zum Waschen von Kleidung benutzt werden konnte. Heute überflutet eine Vielzahl an Seifen, Wasch- und Spülmitteln den Markt.
4.2 Was ist Seife?
Ausgangsstoffe für die Seifenherstellung sind vor allem pflanzliche Fette und Öle, aber auch tierische Abfallfette. Bei den Fetten handelt es sich um Verbindungen des Alkohols Glycerin mit Fettsäuren. Die Fette werden unter Zugabe von Natron- oder Kalilauge stundenlang gekocht („Seifensieden“).
Beim Seifensieden entstehen in einer chemischen Reaktion Glycerin und die Natrium- oder Kaliumsalze der Fettsäuren – kurz: die Seifen.
Seifen sind also die Natrium- oder Kaliumsalze der Fettsäuren.
Im nächsten Punkt werden diese Seifenteilchen auf molekularer Ebene betrachtet und sich daraus ergebende chemische Eigenschaften von Seifen beschrieben.
4.3 Was bewirkt die Seife?
Wasser reicht oft nicht aus, um Fett und Schmutz von Textilien und Körper zu lösen. Wasser kann nämlich nur schwer in die Poren eines Stoffes oder der Haut eindringen und sie benetzen. Fette stoßen Wasser sogar ab, d. h. sie sind wasserabweisend. Erst Wasser und Seife zusammen können Schmutz wirksam ablösen.
Zwischen den polaren Wassermolekülen wirken anziehende Kräfte, vor allem die in 1.2 beschriebenen Wasserstoffbrückenbindungen. Wird durch Druckkräfte von außen der Abstand zwischen den Teilchen verringert, treten sehr starke Abstoßungskräfte auf – Wasser lässt sich daher nur sehr wenig komprimieren. Die anziehenden Kräfte zwischen den Wassermolekülen bewirken, dass sich im Gleichgewichtszustand an der Wasseroberfläche eine gespannte, elastische „Wasserhaut“ bildet. In diesem Zusammenhang spricht man von der Oberflächenspannung des Wassers (= Anziehung der Wassermoleküle untereinander, siebe Abb. 12 und 13). Diese Oberflächenspannung nutzt z. B. ein Wasserläufer aus, um nicht einzusinken.
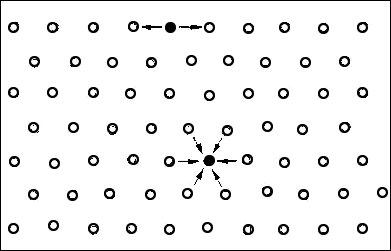
Abb. 12: Im Gleichgewichtszustand heben sich bei den Teilchen in der Oberflächenschicht die nach unten ziehenden Anziehungskräfte und die dadurch entstehende nach oben gerichtete Druckkraft auf – es bleibt nur die in der Oberfläche wirkende Oberflächenspannung übrig.
Das Wasser bildet aber nicht nur eine Haut zur Luft hin aus, sondern an jeder Grenzfläche eines wasserabweisenden Stoffes (z. B. Fette). Man spricht deshalb allgemein von Grenzflächenspannung (hier zwischen einer Fettfläche und einer Wasserfläche). Diese Grenzflächenspannung verhindert, dass Wasser z. B. in eine fettverschmutzte Faser eindringt. Seife verringert nun genau diese Grenzflächenspannung zwischen Fett und Wasser, die Faser wird von der Seifenlösung letztendlich benetzt.
Seife ist ein Tensid.
Seifenmoleküle bestehen aus einer langen hydrophoben (= wasserabweisenden, aber fettlöslichen), unpolaren (=nicht geladenen) Kohlenstoffkette und einem hydrophilen (= wasserliebenden, aber fettunlöslichen), polaren (= elektrisch geladenen) Ende (einer COO--Gruppe).
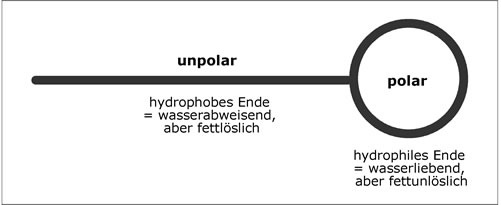
Abb. 13:Schematischer Aufbau eines Seifenmoleküls
Seife ist ein Netzmittel
Kommt nun eine Seifenlösung mit Fett in Berührung, bohrt sich die hydrophobe Kohlenstoffkette der Seifenteilchen in das Fett, die hydrophilen Enden ragen ins Wasser. Da also das wasserabweisende Ende der Seifenmoleküle gleichzeitig fettliebend ist, bilden diese Moleküle eine Brücke zwischen Wasser und Fett. Die Grenzflächenspannung zwischen Wasser und Fett wird verringert, und der fettige Schmutzstoff wird von der Seifenlösung benetzt.
Seifenmoleküle bestehen aus einem fettfreundlichen Teil und einem wasserfreundlichen Teil. Sie häufen sich an der Grenzfläche zwischen Wasser und fettigen Stoffen an. Seifenmoleküle sind demnach grenzflächenaktive Stoffe.
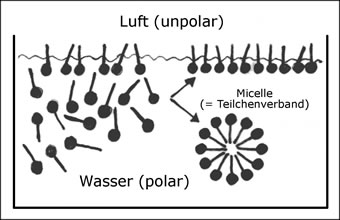
Abb. 14: Grenzflächenaktivität der Seifenmoleküle an der Luft (analog zu fettigem Gewebe)
Fett- und Faseroberfläche sind durch die eingedrungenen Seifenmoleküle negativ geladen. Die dadurch entstehende gegenseitige Abstoßung bewirkt die Ablösung des Schmutzes vom Gewebe.
Seife ist ein Emulgiermittel
Die abgelösten Fettteilchen werden von den Seifenmolekülen vollständig umhüllt. Zwischen ihrem hydrophilen Teil und den Wassermolekülen wirken Anziehungskräfte. Dadurch schweben die Fettteilchen oder Öltröpfchen im Wasser und bilden eine Emulsion. Wasser und Öl trennen sich nicht, wie es ohne Zugabe von Seife ja der Fall wäre.
Seife als Dispergiermittel
Durch die Anlagerung der Seifenmoleküle an den Schmutzteilchen werden diese wie oben beschrieben negativ geladen. Die daraus resultierende gegenseitige Abstoßung bewirkt, dass der Schmutz im fein zerteilten (dispergierten) Zustand bleibt.
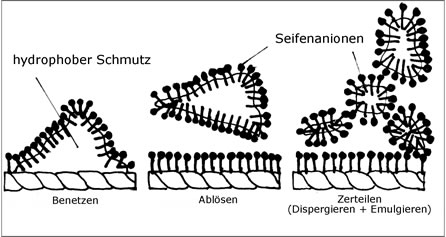
Abb. 15: Schematische Darstellung der Stufen des Waschvorgangs
Seife reinigt, weil ihre langen Molekülkettenenden hydrophob sind: sie „hassen“ Wasser. Um dem Wasser zu entkommen, vergraben sie sich in Fett- und Schmutzpartikel und lösen diese ab.
4.4 Nachteile von Seife
Seife ist zwar ein hervorragendes Reinigungsmittel. Nichtsdestotrotz brennt sie in den Augen und reizt empfindliche Haut. Außerdem wirkt Seife faserschädigend. Wir brauchen lediglich an verfilzte Wollpullis denken.
Seife bildet in hartem Wasser schmierende Flocken, die zu Verkrustungen des Gewebes führen und sich als Grauschleier ablagern. Die Grenzflächenaktivität und die Emulgierwirkung der Seife werden verringert. Somit wird die Reinigungskraft verschlechtert. Denn auch eine zunehmende Zugabe von Seife führt nicht dazu, dass sich die Schmutzpartikel vom Gewebe ablösen. Das Mehr an Seife flockt lediglich aus.
Seife weist in weichem Wasser eine wesentlich stärkere Schaumbildung auf als in hartem Wasser. In hartem Wasser reagieren die Seifenanionen mit den im Wasser enthaltenen Magnesium- und Calciumionen. Es bildet sich ein weißer, flockiger Niederschlag von Kalkseife. Dieser führt zu Verkrustungen des Gewebes und lagert sich als Grauschleier ab. Die Wäsche wird dadurch hart und brüchig, verliert ihre Saugfähigkeit und vergilbt. Mit steigender Wasserhärte steigt auch der Seifenverbrauch, da die gebildete Kalkseife weder grenzflächenaktiv, noch emulgierend wirkt. Die Härte des Wassers wird gemessen in °dH (deutscher Härtegrad). Die in 100 Litern Wasser von 1 °dH enthaltenen Calciumionen fällen 16g Seife aus.
Auch die Kalkablagerungen in vielen Geschirrteilen oder Elektrogeräten lassen sich durch die Wasserhärte erklären. Die gelösten Calciumionen stammen von der so genannten vorübergehenden oder temporären Wasserhärte. Im Wasser ist Calciumhydrogencarbonat Ca(HCO3)2 gelöst. Wird nun das Wasser erhitzt, entweicht aus dem Hydrogencarbonat CO2 und das Wasser H2O verdunstet. Zurück bleibt das nur äußerst schwer lösliche Calciumcarbonat CaCO3, der Kalk, das sich ablagert. Daher treten v.a. überall dort, wo Wasser erhitzt wird, Verkalkungen auf, z.B. Wasserkocher, Waschmaschine, Spülmaschine, Eierkocher, usw. Aber auch die Stalagmiten und Stalaktiten in Tropfsteinhöhlen sind so entstanden.
4.5 Neuere Waschmittel
Diese Nachteile waren u. a. Anlass zur Entwicklung moderner waschaktiver Substanzen. Sie wirken wie Seife gut benetzend und gut emulgierend auf die Schmutz- und Fettteilchen der Wäsche ein. Gegen die Härte des Wassers sind sie aber im Gegensatz zur Seife unempfindlich und verhalten sich völlig neutral.
Die Wasserhärte behindert auch bei modernen Tensiden den Waschvorgang. Deshalb setzt man Wasserenthärtungsmittel ein. Hervorragende Enthärter sind Phosphate, die außerdem noch emulgierend und dispergierend wirken. Allerdings stören sie das biologische Gleichgewicht unserer Gewässer. Sie tragen erheblich an der Überdüngung und letztlich am Absterben ganzer Biotope Schuld.
Nicht nur Fette müssen aus Textilien herausgewaschen werden, sondern auch farbige Flecken, z. B. von Gemüse oder Rotwein. Vollwaschmittel enthalten deshalb auch Bleichmittel.
Fast alle Waschmittel beinhalten auch Enzyme zum Zersetzen von Eiweißflecken (Bratensoße, Blut, Milch).
Einen Gelbstich weist weiße Wäsche nach häufigem Waschen auf. Deshalb enthalten moderne Tenside auch optische Aufheller. Das sind Farbstoffe, die direkt ins Gewebe eindringen und vom Auge als besonders weiß empfunden werden.
4.6 Moderne Waschmittel und Umweltschutz
Unter Punkt 2.5 wurden bereits die negativen Umweltfolgen von Phosphaten in Waschmitteln beschrieben. Daher werden heutzutage Phosphatersatzstoffe wie Silikate oder Zitrate eingesetzt. Eine weitere Maßnahme zum Schutz unserer Umwelt ist die Pflicht zur Angabe von Dosierungsempfehlungen auf den Waschmittelverpackungen. Nur Waschmittel mit hohem Seifenanteil und vollständigem Verzicht auf Phosphate, Bleichmittel, optische Aufheller und Duftstoffe sind umweltfreundlich.
Deshalb kommen immer mehr Haushalte auch wieder auf die ursprünglichen Seifen zurück. So kann Gallseife in der Kläranlage vergleichsweise sehr gut abgebaut werden. Genauso ist Schmierseife zu 99% biologisch abbaubar. Auch versucht man, immer mehr auf den Rohstoff Erdöl zu verzichten und auf nachwachsende Rohstoffe (Ölpflanzen) umzusteigen.
So kann jeder einzelne zum Erhalt einer gesunden Umwelt mithelfen.

