1. Wasser – die wichtigste Substanz der Welt
Wasser ist für Menschen, Tiere und Pflanzen als Nahrungsmittel lebensnotwendig. Der tägliche Wasserbedarf eines Menschen beträgt ca. 2,5 bis 3 Liter. Wasser ist Bestandteil aller Lebewesen: Menschen bestehen aus 60% bis 70% Wasser, manche Pflanzen sogar aus 95% Wasser. Die Erde wird wegen ihres hohen Anteils an Wasser auch der „Blaue Planet“ genannt. Wasser bedeckt rund 71% der Erdoberfläche, wobei aber nur knapp 3% Süßwasser sind, von dem wiederum ein Teil gebunden ist (in den Eiskappen der Pole und Gletscher sowie in Atmosphäre und Boden), so dass uns nur ein geringer Teil der Gesamtwassermenge für die Trinkwasserversorgung zur Verfügung steht. Wasser ist eine kostbare und schützenswerte Lebensgrundlage.
Die Struktur des Wassermoleküls
Die Eigentümlichkeiten des Wassers, u. a. als das am meisten verwendete Lösungsmittel, sein hoher Siedepunkt und seine anomale Dichte beruhen auf seiner Molekülstruktur.
Wasser ist ein Molekül, welches aus einem Sauerstoffatom (O) und zwei Wasserstoffatomen (H) zusammengesetzt ist. Daraus ergibt sich die chemische Formel H2O.
Wassermoleküle sind nicht linear oder rechtwinklig aufgebaut. Die Atomkerne des Sauerstoffatoms und der beiden Wasserstoffatome schließen einen Winkel von 104,5° ein. Aufgrund ihrer Ladungsverteilung haben Wassermoleküle einen positiven Ladungsschwerpunkt (d+) und einen negativen Ladungsschwerpunkt (d-). Wassermoleküle sind also polar und werden deshalb auch als elektrische Dipole bezeichnet.
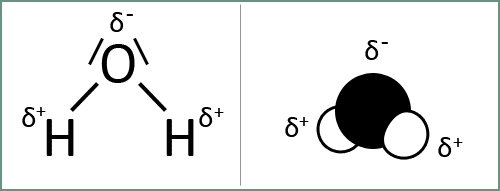
Abb. 1: Das Wassermolekül hat 2 Ladungsschwerpunkte (= 2 Pole): einen negativen beim Sauerstoffatom und einen positiven bei den 2 Wasserstoffatomen.
Die Anziehungskräfte zwischen den partiell negativ geladenen Sauerstoffatomen und den partiell positiv geladenen Wasserstoffatomen verschiedener Wassermoleküle sind stark. Der positive Pol eines Wassermoleküls kann einen negativen Pol eines weiteren Wassermoleküls anziehen. Dadurch kommt es zur Bildung von sehr stabilen zwischenmolekularen Bindungen, die als Wasserstoffbrückenbindungen (WBB) bezeichnet werden (siehe auch Abb. 3).
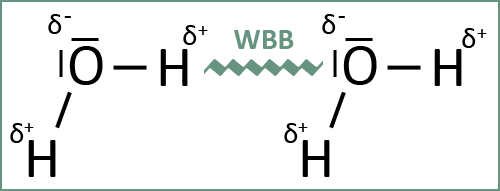
Abb. 2: Wasserstoffbrückenbindung
Die Bindungen (anziehenden Kräfte) zwischen den einzelnen Wassermolekülen (Wasserstoffbrückenbindungen) sind nicht so stark (etwa 1/10 so stark) wie die Bindungen zwischen den H- und O-Atomen innerhalb eines Wassermoleküls. Allerdings sind sie wiederum etwa 10mal so stark wie die anziehenden Kräfte zwischen den einzelnen Molekülen in Wasserdampf, der gasförmigen Zustandsform von Wasser. Die Stärke dieser Wasserstoffbrückenbindungen erklärt, weshalb beim Wasser sehr hohe Energiemengen zugeführt werden müssen, damit Wasser in Wasserdampf übergeht. Die spezielle Form der Wasserstoffbrücken ist auch verantwortlich für die Dichteanomalie und die Bildung von verschiedenen Typen von Eis.

